2025年8月15日,美国食品药品监督管理局(FDA)已批准司美格鲁肽Wegovy®(Semaglutide 2.4 mg)的补充新药申请(sNDA),用于治疗伴有中度至进展期纤维化(F2至F3期)的非肝硬化代谢相关脂肪性肝炎(MASH)成人患者,用药时需联合低热量饮食及增加体力活动。
诺和诺德执行副总裁、首席科学官兼研发负责人Martin Holst Lange表示:司美格鲁肽是首个且唯一获得FDA批准用于治疗MASH的GLP-1药物,其不仅可以阻止疾病进展,还能逆转肝脏损伤。这一获批基于其在减重、心血管获益方面的丰富证据及ESSENCE试验数据,为患者提供一种新的治疗选择。
·
l FDA最初于2021年批准司美格鲁肽用于伴低热量饮食及增加体力活动的减重治疗,适用人群为肥胖或超重且有体重相关医疗问题的成人,以减轻体重并长期维持。
l 2022年,该适应症扩大到12岁及以上肥胖儿童。
l 2024年,司美格鲁肽获批用于降低已知患有心脏病和肥胖或超重的成人发生重大心血管事件(如死亡、心脏病发作或中风)的风险。
关于MASH
MASH是一种严重的、进行性代谢性疾病,全球患者超过2.5亿,预计到2030年进展期病例数将翻倍。在超重或肥胖人群中,超过1/3同时患有MASH。该病早期症状隐匿,常导致病情识别不及时,且患者进展为晚期肝病(包括肝癌)的风险显著高于普通人群。
ESSENCE试验
此次加速批准基于ESSENCE试验第一部分的结果。在该研究中,与安慰剂组相比,司美格鲁肽可显著改善肝纤维化且MASH无恶化;同时,还可缓解MASH且肝纤维化无恶化,具有统计学意义。

ESSENCE试验是一项多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验,共纳入1197名经肝活检确诊为MASH(NAFLD活动性评分≥4)且肝纤维化分期为F2-F3的成年患者。按2:1比例随机分配至司美格鲁肽组(每周一次,皮下注射2.4mg)和安慰剂组,治疗周期为240周或直至发生肝脏相关临床事件。
ESSENCE 试验分为两部分,
l 第一部分是评估前800例患者,证明司美格鲁肽(2.4mg)治疗可在72周时改善肝脏组织学;
l 第二部分主要评估在治疗240周时,与安慰剂组相比,在患有MASH和中度至进展期纤维化的成年患者中,司美格鲁肽(2.4mg)治疗可降低肝脏相关临床事件的风险。
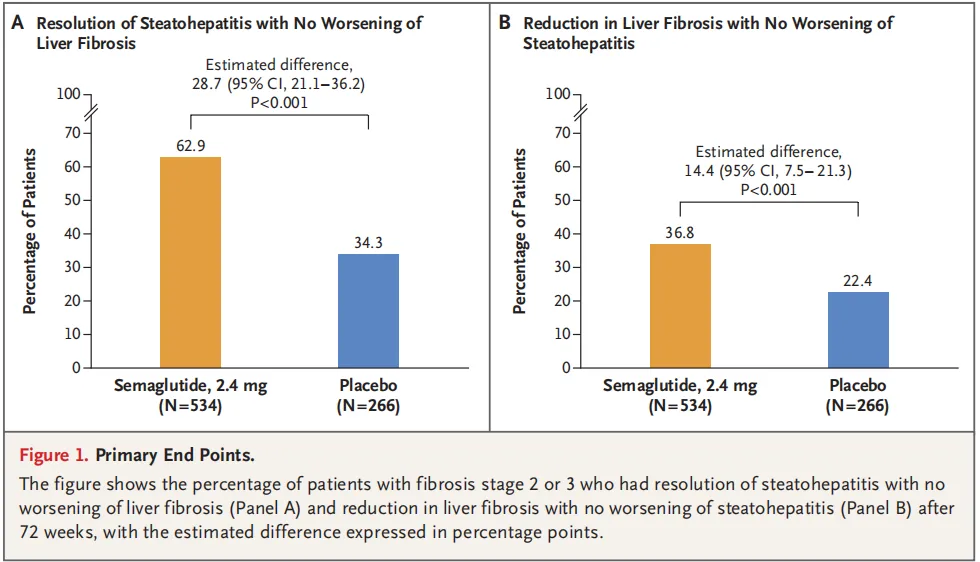
第一部分的研究结果表明:
l 司美格鲁肽组中有62.9%的患者达到MASH缓解且纤维化无恶化,而安慰剂组为34.3%(估计差异28.7个百分;95%CI:21.1-36.2;P<0.001)。
l 司美格鲁肽组中有36.8%的患者实现肝纤维化改善且MASH无恶化,而安慰剂组为22.4%(估计差异14.4个百分点;95%CI:7.5-21.3;P<0.001)。
l 非侵入性检测(NIT)指标:基线指标包括FIB-4指数、增强肝纤维化评分(ELF)、受控衰减参数(CAP)、肝脏硬度测量(LSM)及III型前胶原肽(PRO-C3)。
1、ELF:司美格鲁肽组55.8%的患者实现≥0.5的下降,安慰剂组仅25.5%。
2、LSM:司美格鲁肽组52.0%的患者达到≥30%的改善,安慰剂组为30.3。
3、PRO-C3和其他指标:均显示司美格鲁肽组显著优于安慰剂组。
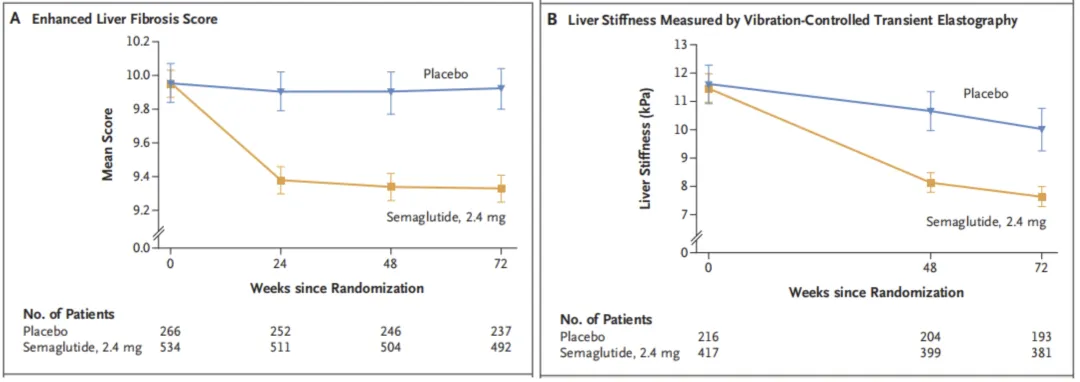
Figure 2. ELF and LSM from Baseline to Week 72
福瑞股份旗下子公司Echosens已与诺和诺德公司达成了全球战略合作伙伴关系,双方旨在共同推进MASH的早期诊疗,并提高患者、医疗保健提供者及其他相关方对该疾病的认知度。





